Fièvre du Nil occidental
La fièvre du Nil occidental est est une maladie infectieuse causée par un arbovirus appartenant à la famille des Flaviviridae. On la trouve actuellement en Afrique, en Europe, au Moyen-Orient, en Amérique du Nord et en Asie occidentale.
Dernière mise à jour le 01 décembre 2025
L’essentiel
- La fièvre du Nil occidental est causée par un arbovirus appartenant à la famille des Flaviviridae et au genre des Orthoflavivirus
- On trouve actuellement le virus en Afrique, en Europe, au Moyen-Orient, en Amérique du Nord et en Asie occidentale
- Transmis par des moustiques Culex, le virus peut provoquer des atteintes neurologiques chez l’être humain. Dans la grande majorité des cas, la maladie est asymptomatique
- Des cas autochtones d’infection ont été recensés en France hexagonale
Origine de la fièvre du Nil occidental
Historique
Le virus du Nil occidental (WNV pour West Nile virus, en anglais) est à l’origine d’une zoonose : la fièvre du virus du Nil occidental.1 Il a été isolé pour la première fois en 1937 chez une femme dans le Protectorat de l’Ouganda (l’actuelle République d’Ouganda), dans la province du Nil occidental.2 Des cas sporadiques ont été détectés plus tard dans les années 1950 chez l’humain en Égypte et Israël.1
C’est dans les années 1960 que le virus aurait été introduit en Europe par des oiseaux migrateurs venus d’Afrique subsaharienne et du Moyen-Orient. Avec 13 cas humains dénombrés en Camargue entre 1962 et 1964, la France a été le premier pays européen où ont été rapportés des infections humaines par le WNV.1,3
La première épidémie d’importance chez l’humain a eu lieu en Afrique du Sud en 1974.4 Mais c’est à la fin des années 1990 que le virus a retenu l’attention de la communauté scientifique : des cas humains d’une sévérité inhabituelle sont survenus au cours de neuf épidémies ayant sévi dans des pays du pourtour méditerranéen (Algérie, Maroc, Tunisie, France, Italie, Israël) et des pays d’Europe centrale et de l’Ouest (Roumanie, Russie).4
En 1999, un virus du Nil occidental circulant en Tunisie et en Israël a été importé à New York, révélant son potentiel épidémique. La flambée spectaculaire de grande ampleur qui s’est propagée de 1999 à 2010 sur le territoire des États-Unis a souligné le danger, pour le monde entier, que représente ce virus émergent, endémique désormais en Amérique du Nord.5,6 Entre 1999 et 2006, l’infection liée au virus du Nil occidental a causé aux États-Unis le décès de 962 personnes ; près de 24 000 infections ont été documentées dont près de 9 900 étant des formes neuro-invasives.6
On trouve actuellement le virus en Afrique, en Europe, au Moyen-Orient, en Amérique du Nord et en Asie occidentale.5
Épidémiologie en Europe
Après quelques épidémies sporadiques, la première épidémie majeure en Europe a eu lieu en 1996 en Roumanie, avec près de 400 cas humains et l’apparition de premiers signes neurologiques graves.7 Depuis, essentiellement depuis 2010, les épidémies et les foyers épizootiques se sont multipliés, surtout en Europe centrale et en Méditerranée orientale où le virus est endémique, zones situées sur les principaux axes migratoires des oiseaux.5,8
L’année 2018 a été particulièrement remarquable, avec la plus importante épidémie décrite en Europe et un nombre de cas recensés supérieur à la somme des sept années précédentes. Des cas humains ont été signalés pour la première fois en Allemagne en 2019 et 2020 et aux Pays Bas en 2020.8
En 2024, 19 pays européens ont signalé 1 436 cas humains autochtones d’infection par le WNV, dont 235 décès, principalement en Italie (455 cas et 21 décès) et en Grèce (217 cas et 34 décès).9
Depuis le début de l’année jusqu’au 13 août 2025, huit pays européens ont signalé des cas humains d’infection par le WNV : 1 cas en Bulgarie, 1 en Hongrie, 5 en Roumanie, 13 en France, 24 en Grèce, 9 en Serbie, 1 en Espagne et 267 en Italie.10

Épidémiologie en France
Depuis 1962, où il a été détecté pour la première fois en France, le virus du Nil occidental est régulièrement repéré sur le pourtour méditerranéen.1,3,8
Des cas humains d’infection au WNV ont ainsi été identifiés en France en 2003, avec un accroissement de la circulation du virus depuis 2015.6
En 2024, 38 cas autochtones d’infection ont été signalés dans les régions Provence-Alpes-Côte d’Azur, Occitanie et Nouvelle-Aquitaine : 24 cas dans le Var, 9 dans l’Hérault, 3 dans le Gard, 1 en Gironde et 1 dans les Pyrénées-Atlantiques. Le tribut de l’année 2024 a été l’un des plus élevé, proche de celui de 2023, avec 39 cas, et nettement supérieur à ceux de 2022 (6 cas) et 2021 (aucun cas). Depuis 2021, la maladie est inscrite sur la liste des maladies à déclaration obligatoire chez l’homme, permettant ainsi de renforcer sa surveillance.11
Depuis le début de l’année 2025, jusqu’au 19 août, 13 cas autochtones d’infection ont été dénombrés en France hexagonale. Trois épisodes ont été recensés en Provence-Alpes-Côte d’Azur (9 cas), 1 en Île de France (2 cas), 1 en Corse (1 cas) et 1 en Occitanie (1 cas). La première détection du virus en 2025 a eu lieu dans le Var le 29 juillet.12
L’épisode francilien concernait deux patients sans antécédents ni facteurs de risque, ayant développé une forme neurologique. La jeune femme de 25 ans, qui n’avait pas voyagé récemment, présentait une méningite accompagnée d’un nystagmus (oscillation rythmique involontaire de l’un ou des deux yeux), manifestation rarement décrite lors d’une infection par le virus du Nil occidental. L’homme de 64 ans avait séjourné dans le Jura et présentait une encéphalite associée à un syndrome cérébelleux*. Les deux patients n’ont reçu aucun traitement. Ils sont sortis indemnes et sans séquelles après quelques jours d’hospitalisation. Un troisième cas en Île-de-France est en cours d’investigation.
* atteinte du cervelet se caractérisant par des pertes d’équilibre, des problèmes d’élocution, des difficultés pour marcher ou encore effectuer des gestes précis
Le virus du Nil occidental
Le virus du Nil occidental (WNV) est un arbovirus à ARN monocaténaire de polarité positive, appartenant à la famille des Flaviviridae et au genre des Orthoflavivirus, comme le virus Zika et le virus de la dengue.6,13 Il peut infecter l’être humain, le cheval et d’autres mammifères.5,14
Neuf lignées phylogénétiques ont été décrites. En Europe, les lignées 1 et 2 provoquent la maladie chez l’humain.13,15 La lignée 3 est potentiellement pathogène pour l’espèce humaine.16
Transmission
Transmission par piqûre de moustique
La fièvre du Nil occidental est une arbovirose.2,6,14
Les oiseaux constituent le principal réservoir du virus et sa transmission entre oiseaux virémiques et non infectés est majoritairement assurée par des femelles moustiques du genre Culex.17

En France métropolitaine, deux espèces sont principalement impliquées : Culex pipiens, parfois très abondant en ville, et Culex modestus, plutôt rural.17 Culex pipiens pipiens se nourrit sur divers hôtes (oiseaux, mammifères) et joue un rôle majeur dans la transmission du virus. Culex pipiens molestus se nourrit principalement sur mammifères et joue probablement un rôle limité dans la transmission.17
Culex modestus piquent de préférence les oiseaux mais également les humains et d’autres animaux.17
D’autres moustiques, comme Aedes albopictus, peuvent répliquer ou transmettre le virus du Nil occidental. Cependant leur importance épidémiologique en France n’a pas été démontrée.17
La circulation du virus suit une saisonnalité, en lien avec la période de reproduction des moustiques qui commence au printemps et s’achève en automne. Les chevaux et l’être humain sont des hôtes accidentels du virus ou des impasses épidémiologiques (la virémie est insuffisante pour infecter le moustique lors d’une piqûre et permettre ainsi la transmission de la maladie).8,14
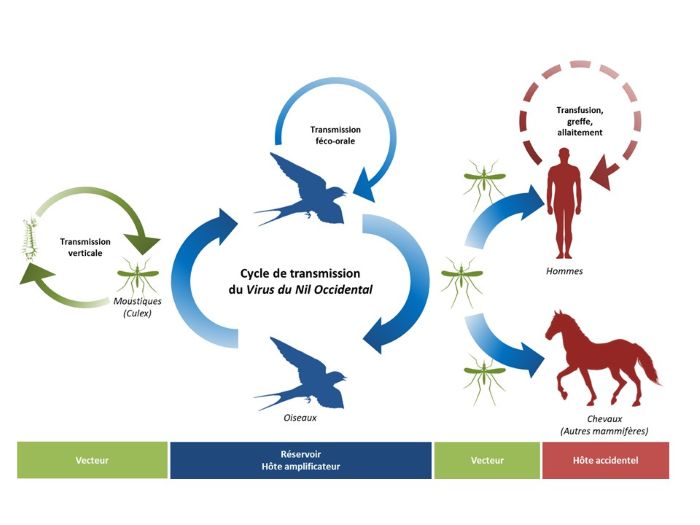
Transmission par produits d’origine humaine
La transmission interhumaine peut se produire par le biais de substances d’origine humaine : transfusion de sang, transplantation de tissus, de cellules ou d’organes provenant d’un donneur infecté et virémique.17
Diagnostic
La période d’incubation dure généralement entre deux à six jours, jusqu’à 21 jours chez les immunodéprimés.6 Le diagnostic d’une infection par le WNV repose sur une détection indirecte basée sur la sérologie (sérum et liquide céphalo-rachidien ; réactivité croisée avec virus du genre Orthoflavivirus), mais aussi directe (PCR sur sang total, plasma à partir de J2, sérum, liquide céphalo-rachidien en cas d’implications neurologiques et urine).8
Symptômes et traitement de la fièvre du Nil occidental
Symptômes
Les infections humaines par le virus du Nil occidental sont asymptomatiques dans 80 % des cas ; cependant, 20 % des patients peuvent développer une forme symptomatique avec de la fièvre, des myalgies, des malaises, des nausées, des vomissements ou des éruptions cutanées, qui s’estompent généralement en une semaine.5,6,18
On retrouve des complications neurologiques (méningite, encéphalite et paralysies flasques) chez moins de 1 % des patients,6,18 mais aussi des syndromes de Guillain-Barré qui peuvent entraîner le décès.18 Parmi les formes graves, la létalité peut atteindre jusqu’à 17 %, en particulier chez des populations à risque comme les immunodéprimés et les personnes âgées.5,19 Les facteurs de risque comprennent l’âge avancé, les tumeurs malignes perturbant la barrière hémato-encéphalique, l’hypertension, les troubles hématologiques, le diabète sucré, les maladies rénales, l’abus d’alcool et les facteurs génétiques.19
Les traitements
Il n’existe pas de traitement curatif pour l’espèce humaine, en particulier pas d’immunoglobulines spécifiques thérapeutiques homologuées. Des soins de soutien sont administrés aux patients atteints de formes neuro-invasives, impliquant une hospitalisation, une assistance respiratoire et une surveillance étroite des fonctions vitales.13
- Les pistes de recherche
Des recherches sur les traitements antiviraux, incluant à la fois des molécules antivirales et des anticorps monoclonaux, sont en cours mais restent limitées. Plusieurs candidats ont été identifiés et testés principalement sur des modèles animaux avec des résultats encourageants. Parallèlement, des anticorps monoclonaux ciblant la protéine E du virus du Nil occidental ont montré une efficacité prometteuse en améliorant la survie et en réduisant la charge virale dans ces modèles. Cependant, aucun traitement spécifique n’est encore approuvé pour un usage humain, en partie à cause des difficultés liées à la mise en place rapide d’essais cliniques.20
Certaines pistes de recherche s’orientent également vers l’identification et l’optimisation de nouveaux inhibiteurs, notamment ceux ciblant l’ARN polymérase dépendante de l’ARN (celle catalysant la synthèse de l’ARN complémentaire à un modèle d’ARN donné).21
La prévention
Les vaccins
Il n’y en a pas encore de disponible, toutefois des produits comme West Nile-Innovator® (Zoetis) et Recombitek® Equine West Nile Virus (Merial), qui ont montré leur efficacité chez les chevaux, pourraient servir de modèles pour l’élaboration de vaccins humains.
- Les pistes de recherche
Parmi les approches étudiées, les vaccins inactivés chez l’animal ont montré une bonne réponse immunitaire. C’est le cas, sur des oiseaux de zoo pour lesquels la vaccination a déclenché une forte augmentation des anticorps neutralisants.22
Plusieurs essais cliniques sont en cours pour évaluer la sécurité, l’immunogénicité et les effets secondaires de candidats vaccins* chez l’humain :
- En phase 1 : un vaccin vivant atténué (WN/DEN4Δ30) ; un vaccin à ADN (VRC-WNVDNA020-00-VP) ; un vaccin sous-unitaire (HBV-002) ; un vaccin vivant inactivé (HydroVax-001B)
- En phase 2 : un vaccin vivant atténué (ChimeriVax-WN02)
*on peut trouver parmi ceux-ci des vaccins chimériques (ChimeriVax-WN02) ou des vaccins multi-peptides21
La surveillance et la lutte anti-vectorielle
Des mesures individuelles peuvent être prises pour diminuer l’exposition au moustique, comme le port de vêtements couvrants, l’usage de répulsifs, serpentins, diffuseurs électriques ou de moustiquaires. Les mesures collectives comprennent la lutte contre les gîtes larvaires et selon la situation entomologique, d’éventuelles mesures contre les moustiques adultes.8
Des mesures spécifiques sont mises en place pour la sécurisation de la transfusion et des dons d’organes et tissus. Elles sont basées sur le dépistage des donneurs ou l’exclusion des donneurs à risque. Ces mesures sont prises en application des recommandations émises par le Haut Conseil de la Santé Publique (HCSP) et son groupe de travail permanent Sécurité des éléments et produits du corps humain (SECPROH).8
- Les pistes de recherche
Une prévention efficace dépend de l’élaboration de programme complets et intégrés de surveillance des moustiques. C’est la raison pour laquelle il est prévu de cartographier les écosystèmes et leurs modifications sous l’influence du changement climatique pour suivre l’évolution du risque lié au virus du Nil occidental.21
Les actions de l’ANRS Maladies infectieuses émergentes
L’ANRS Maladies infectieuses émergentes soutient la recherche sur le virus du Nil occidental et ses vecteurs, avec un ensemble de projets d’un montant global d’environ cinq millions d’euros, couvrant plusieurs domaines tels que la clinique, la lutte antivectorielle et la surveillance.
Mieux comprendre l’histoire naturelle de la maladie
Pour une meilleure compréhension de la maladie, l’ANRS MIE finance par l’intermédiaire de l’AAP Émergences PRFI des projets comme le projet IFNArboVE. Ce projet, porté par une équipe française (Shenying Zhang de IHU Institut Imagine, Paris) et une équipe brésilienne (Carolina Prando, Pelé Pequeno Príncipe Research Institute), explore le rôle central d’une déficience de l’immunité à l’interféron de type I dans la survenue des formes neuro-invasives sévères, en particulier les encéphalites, provoquées par les arbovirus (virus du Nil occidental, dengue, Zika, chikungunya, Oropouche).
Traitement
L’agence encourage des projets de recherche sur les traitements. Le projet NeuroFlaviNA, mené par Suzanne Peyrottes (CNRS) et financé dans le cadre de l’AAP PEPR MIE 2024, a pour objectif de développer de nouvelles molécules dont des analogues de nucléosides capables de traverser efficacement la barrière hémato-encéphalique pour traiter les infections neuro-invasives à Orthoflavivirus émergents ou ré-émergents.
Vecteurs et lutte antivectorielle
L’ANRS MIE est impliquée dans divers projets de recherche qui ont bénéficié d’un financement dans le cadre de différents Appels à projets de l’agence :
- Le projet ArboRetro (AAP PEPR MIE 2024) : porté par Carla Saleh (Institut Pasteur), il vise à identifier et à inactiver génétiquement les rétrotransposons des moustiques qui favorisent la tolérance virale, afin d’interrompre le cycle de vie des arbovirus et d’empêcher leur transmission.
- Le projet CUDISEMED (AAP Émergences PRFI 2024) : coordonné par Christian Mitri (Institut Pasteur) et Nabil Haddad (Université américaine de Beyrouth), il s’intéresse à la dynamique de circulation du virus du Nil occidental et du virus Usutu dans le bassin méditerranéen, en lien avec les migrations d’oiseaux et le changement climatique, en étudiant notamment les populations de
Surveillance
L’agence soutient les projets visant à améliorer la surveillance. Par exemple :
- Le projet ArboFaso (AAP Émergences PRFI 2022, Burkina Faso) : mené par Yannick Simonin (université de Montpellier) et Bachirou Tinto (IRSS, centre MURAZ), il adopte une approche intégrée « Une seule santé » pour évaluer et surveiller le risque arboviral au Burkina Faso. Il étudie la circulation des virus chez l’homme, les animaux domestiques et sauvages, et leurs vecteurs, en milieux urbains et périurbains.
- Lors de la situation exceptionnelle de circulation des virus Usutu et du Nil occidental en Nouvelle Aquitaine, un programme de recherche porté par Alexandre Duvignaud de l’université de Bordeaux a mobilisé les acteurs régionaux et nationaux en santé humaine, vétérinaire et environnementale. Dans ce cadre, une étude de séroprévalence préliminaire chez les chevaux a confirmé la circulation du virus du Nil occidental en Nouvelle-Aquitaine. Ce dispositif a démontré son intérêt pour une surveillance intégrée. L’extension de cette approche pourrait être envisagée en Île-de-France.
- Dans le cadre de l’appel à candidatures ANRS MIE-Arbo-France qui attribue trois bourses de thèse en arbovirologie à des jeunes chercheurs ayant des projets innovants dans le champ thématique de la stratégie anti-vectorielle, Djara Konate a vu sa thèse intitulée « Avian and equine surveillance for two flaviviruses in Burkina Faso » financée en 2024. Son projet vise à surveiller par des techniques moléculaire et sérologique les virus Usutu et du Nil occidental chez les oiseaux domestiques et sauvages ainsi que chez les chevaux, en zones urbaines et périurbaines du Burkina Faso, afin d’identifier les espèces aviaires du cycle enzootique, les souches circulantes et à valider l’intérêt des chevaux comme sentinelles.
Arbo-France
En collaboration avec l’ANRS MIE, Arbo-France a consacré en novembre 2023 une journée scientifique à la surveillance du virus du Nil occidental. Cette journée a mis en avant la nécessité d’un dispositif de surveillance intégrée du virus, combinant surveillance réglementaire et recherche appliquée, pour répondre à l’expansion de sa circulation et répondre aux risques pour l’espèce humaine. Cette journée a également souligné l’importance d’une stratégie nationale structurée régionalement, dotée d’outils de collecte et d’analyse de données, d’une coordination inter-administrations et de moyens financiers.
Pour en savoir plus
Financement de la recherche sur la fièvre du Nil occidental
La vocation première de l’ANRS MIE est de soutenir les travaux scientifiques relatifs aux maladies infectieuses émergentes, parmi lesquelles figure le virus du Nil occidental.
Pour permettre ces soutiens, plusieurs dispositifs de financement ont vu le jour.
Nous vous recommandons de consulter la liste intégrale de nos appels à projets afin de trouver celui qui correspond le mieux à vos objectifs.
L’ANRS MIE a ouvert une cellule de crise de niveau 1 le 21 août 2025 en réponse à l’évolution de la situation de la fièvre du Nil occidental en France.
Références
- Abbas I, et al. Epidemiology and surveillance of West Nile virus in the Mediterranean Basin during 2010–2023: A systematic review. Curr Res Parasitol Vector Borne Dis 2025;7:100277
- Simonin Y. Circulation of West Nile virus and Usutu virus in Europe: Overview and challenges. Viruses 2024;16:599
- Joubert L, et al. Epidemiology of the West Nile virus: Study of a focus in Camargue. IV. Meningo-encephalomyelitis of the horse. Ann Inst Pasteur 1970 ; 118 : 239–247
- Lanteri MC, et al. Le virus West Nile. I. La conquête de l’Ouest. Médecine / sciences 201 ; 27 :375-381
- OMS : Virus du Nil occidental. https://www.who.int/fr/news-room/fact-sheets/detail/west-nile-virus (consulté le 11/09/2025)
- Rapport d’évaluation technologique : Test d’amplification des acides nucléiques pour le diagnostic biologique de l’infection par le virus du Nil occidental. Haute Autorité de santé, mai 2019
- Sirbu A, et al. Outbreak of West Nile virus infection in humans, Romania, July to October 2010. Euro Surveill 2011;16(2):pii=19762
- Santé publique France : West Nile virus https://www.santepubliquefrance.fr/maladies-et-traumatismes/maladies-a-transmission-vectorielle/west-nile-virus/la-maladie/#tabs (consulté le 11/09/2025)
- ecdc : Historical data on local transmission in Europe for West Nile virus. https://www.ecdc.europa.eu/en/west-nile-fever/surveillance-and-disease-data/historical (consulté le 11/09/2025)
- ecdc : Surveillance of West Nile virus infections in humans in Europe, weekly report. https://www.ecdc.europa.eu/en/infectious-disease-topics/west-nile-virus-infection/surveillance-and-updates-west-nile-virus (consulté le 13-08-2025)
- Bilan de la surveillance humaine du virus West Nile (ou virus du Nil Occidental) en France hexagonale en 2024. Santé publique France, mai 2025
- Santé publique France : Chikungunya, dengue, Zika et West Nile en France hexagonale. Bulletin de la surveillance renforcée du 27 août 2025. https://www.santepubliquefrance.fr/maladies-et-traumatismes/maladies-a-transmission-vectorielle/chikungunya/documents/bulletin-national/chikungunya-dengue-zika-et-west-nile-en-france-hexagonale.-bulletin-de-la-surveillance-renforcee-du-27-aout-2025 (consulté le 13/08/2025)
- Kocabiyik DZ, et al. West Nile virus – a re-emerging global threat: recent advances in vaccines and drug discovery. Front Cell Infect Microbiol 2025;15:1568031
- Dauphin G, et al. West Nile: worldwide current situation in animals and humans. Comp Immunol Microbiol Infect Dis 2004;27(5):343-355
- Mencatelli G, et al. Spatial and temporal dynamics of West Nile virus between Africa and Europe. Nat Commun 2023;14(1):6440
- Davis E, et al. Evidence of lineage 1 and 3 West Nile virus in person with neuroinvasive disease, Nebraska, USA, 2023. Emerg Infect Dis 2024;30:2090-2098
- Note du Comité de Veille et d’Anticipation des Risques Sanitaires (COVARS) du 20 octobre 2023 sur les risques sanitaires liés aux virus WEST NILE et USUTU. https://sante.gouv.fr/IMG/pdf/note_covars-20oct23.pdf (consulté le 11/09/2025)
- Bai F, et al. Current understanding of West Nile virus clinical manifestations, immune responses, neuroinvasion, and immunotherapeutic implications. Pathogens 2019;8(4):193
- ecdc : West Nile virus infection. Risk for people. https://www.ecdc.europa.eu/en/west-nile-virus-infection (consulté le 11/09/2025)
- Calvert AE, et al. A scoping review of preclinical research on monoclonal antibody development for prophylaxis and treatment of West Nile virus Infections. Viruses 2025;17: 845
- Singh P, et al. West Nile Virus in a changing climate: epidemiology, pathology, advances in diagnosis and treatment, vaccine designing and control strategies, emerging public health challenges – a comprehensive review. Emerg Microbes Infect 2025;14(1):2437244
- Bergmann F, et al. Vaccination of Zoo Birds against West Nile Virus-A Field Study. Vaccines 2023;11:652
