Fièvre de la Vallée du Rift
La fièvre de la Vallée du Rift est une maladie infectieuse due à un arbovirus. Elle affecte principalement les animaux mais aussi toucher l’être humain.
Dernière mise à jour le 05 février 2026
L’essentiel
- La fièvre de la Vallée du Rift est une arbovirose.
- La transmission à l’être humain se fait le plus souvent par contact avec des liquides corporels ou des tissus infectés.
Origine de la fièvre de la Vallée du Rift
Historique
La fièvre de la Vallée du Rift (FVR) est une arbovirose.1 Elle a été isolée pour la première fois en 1931 lors d’une épizootie ovine au Kenya dans la Vallée du Rift.2 La première grande épidémie humaine a eu lieu en 1977 en Égypte, où entre 18 000 et 200 000 cas ont été recensés, avec environ 600 décès.1
Endémique en Afrique subsaharienne et au Moyen-Orient, elle surgit après des pluies exceptionnelles favorisant la prolifération des moustiques.1,2 En France, en 2007, Mayotte avait enregistré dix cas humains confirmés de FVR, principalement liés au contact avec des ruminants.3 En 2018–2019, l’archipel recensait 142 cas confirmés, dont 73 % résultaient d’une exposition animale.4 L’épidémie a pu être contrôlée à l’époque grâce à des enquêtes vétérinaires, une lutte antivectorielle et une prévention adaptée.
Le virus de la FVR
Le virus de la FVR est un arbovirus, un virus transmis par la piqûre de vecteurs arthropodes hématophages. Ce virus à ARN simple brin appartient au genre Phlebovirus de la famille des Phenuiviridae et de l’ordre des Bunyavirales.1,5,6
Transmission
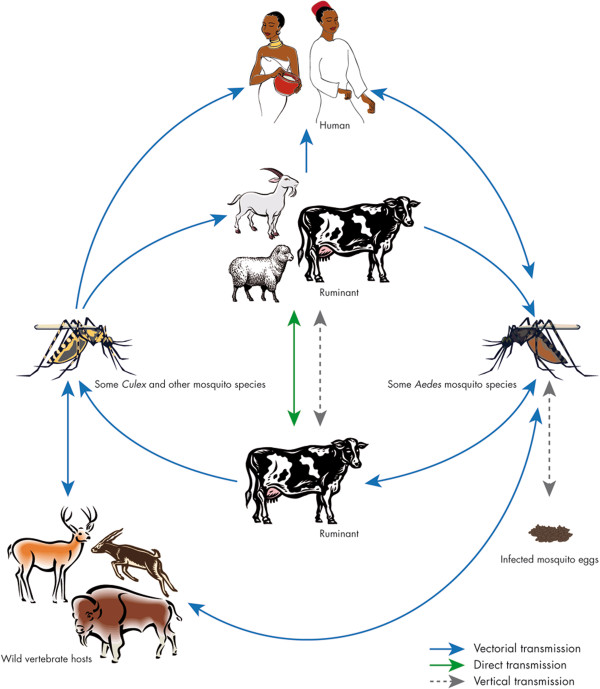
Transmission par piqûre de moustique
La FVR affecte principalement les ruminants (ovins, bovins, caprins, camélidés).7 La transmission vectorielle par la piqûre de moustiques infectés (Aedes et Culex, notamment A. albopictus et C. pipiens) joue un rôle majeur dans la propagation du virus chez l’animal, mais semble moins impliquée dans la transmission à l’être humain.7
Le virus persiste dans les foyers primaires via un cycle Aedes-animaux avec transmission verticale chez les moustiques. Les flambées majeures se propagent vers des foyers secondaires par déplacement de bétail, faune sauvage ou dispersion de vecteurs, puis s’amplifient chez les ruminants chez les ruminants grâce aux Culex dans les zones irriguées. Les épizooties précèdent systématiquement les épidémies humaines.7
Transmission à l’être humain
Dans la plupart des cas, l’infection résulte d’un contact direct ou indirect avec du sang ou des organes d’animaux contaminés, au cours de l’abattage ou de la découpe, pendant les mises-bas et les interventions vétérinaires ou lors de l’élimination des carcasses ou des fœtus.7 La contamination pourrait également survenir en cas d’ingestion de lait cru ou non pasteurisé en provenance d’animaux infectés.7
Aucune transmission interhumaine n’a encore été documentée.7
Diagnostic
La FVR peut être cliniquement difficile à distinguer d’autres maladies infectieuses telles que le paludisme, la dengue, la fièvre jaune ou d’autres fièvres hémorragiques virales.7 Les symptômes, tels que fièvre, maux de tête, douleurs musculaires, et parfois des manifestations hémorragiques ou neurologiques, peuvent également ressembler à d’autres infections systémiques.
Le diagnostic de la FVR peut être confirmé par plusieurs méthodes de laboratoire, notamment :6,7
- La RT-PCR : pour détecter l’ARN viral dans le sang ou d’autres fluides corporels, particulièrement efficace pendant la phase aiguë de la maladie.
- Les tests ELISA : pour détecter les antigènes viraux ou les anticorps (IgM et IgG) spécifiques à la FVR, utiles pour confirmer une infection récente ou passée.
- L’isolement viral : par culture cellulaire, bien que cette méthode soit principalement utilisée dans des laboratoires spécialisés à haut confinement.
- Les tests de neutralisation du sérum : pour identifier les anticorps neutralisants, souvent utilisés pour des études rétrospectives ou épidémiologiques.
Symptômes et traitement de la fièvre de la Vallée du Rift
Les symptômes
Chez les animaux, la FVR provoque des avortements massifs et une mortalité élevée.2,7
Chez l’humain, la majorité des cas sont asymptomatiques. Parmi les cas symptomatiques, les manifestations cliniques les plus courantes sont la fièvre (81 %), l’insuffisance rénale (41 %), les nausées (38 %) et l’encéphalite (21 %). Le décès survient dans 21 % des cas ; la plupart des personnes décédés avaient été hospitalisées.8
La période d’incubation est comprise entre deux et six jours.7
Les traitements
Il n’existe aucun traitement spécifique disponible à ce jour contre le virus de FVR. Pour la plupart des cas humains, où la maladie est relativement bénigne et de courte durée, aucun traitement spécifique ne s’impose. La prise en charge repose sur un traitement symptomatique visant à soulager la fièvre, les douleurs et à prévenir les complications hépatiques ou oculaires.7,9
Pour les cas plus graves, le traitement repose principalement sur des soins de soutien précoces et intensifs, axés sur la réhydratation et le traitement des symptômes.7
- Les pistes de recherche
Des recherches sont en cours pour identifier des molécules antivirales actives contre le virus FVR, notamment parmi des composés déjà approuvés pour d’autres maladies virales. Certains antiviraux comme la ribavirine, le favipiravir ou des inhibiteurs de la réplication virale ont montré une efficacité partielle in vitro ou chez l’animal, mais aucun n’a encore démontré une efficacité clinique suffisante chez l’humain).10
Les résultats obtenus avec deux anticorps monoclonaux capables de conférer une protection post-exposition chez des modèles murins ouvrent des perspectives prometteuses pour une future immunothérapie ciblée chez l’humain.11
La prévention
La prévention repose d’abord sur des mesures non médicales visant à limiter la transmission du virus. Cela inclut la réduction du risque de transmission de l’animal à l’humain par le port de gants et d’équipements de protection lors de la manipulation d’animaux ou de leurs produits biologiques.
La protection individuelle et communautaire contre les piqûres de moustiques est aussi essentielle : moustiquaires imprégnées, vêtements couvrants, répulsifs et aménagements des habitations. Enfin, la lutte antivectorielle joue un rôle clé, notamment par la gestion des eaux stagnantes, l’utilisation ciblée d’insecticides et la surveillance entomologique dans les zones à risque.7,9
Vaccins
À l’heure actuel, seul un vaccin a été utilisé chez l’humain. Il s’agit d’un vaccin inactivé, développé par l’armée américaine, le TSI-GSD-200 ; il n’est toutefois pas encore commercialisé et son usage reste expérimental, destiné à protéger les vétérinaires et le personnel de laboratoire à haut risque.2,12
- Les pistes de recherche
Plusieurs candidats vaccins sont en cours de développement, parmi lesquels le vaccin inactivé TSI-GSD-200 et le vaccin vivant atténué MP-12 qui ont montré une bonne immunogénicité. Tous les deux sont actuellement étudiés dans les essais cliniques de Phase II.13
L’université d’Oxford, dans un projet soutenu par CEPI (Coalition for Epidemic Preparedness Innovations), a développé le vaccin ChAdOx1 RVF. Il s’agit d’un vaccin reposant sur un vecteur adénoviral similaire à celui utilisé pour créer le vaccin contre la Covid-19. Les essais précliniques et de Phase I ont permis de démonter une bonne sécurité, une forte immunogénicité et une thermostabilité prometteuse. Il est actuellement étudié au Kanya dans un essai clinique de Phase II mené par le KEMRI-Wellcome Trust Research Programme, ce qui en fait l’un des candidats les plus avancés pour une utilisation humaine dans les zones endémiques.
L’approche vaccinale contre la FVR a beaucoup évaluée. Elle est ainsi basée, par exemple, sur la possibilité de distinguer les individus vaccinés de ceux infectés par sérologie (DIVA : Differentiating Infected from Vaccinated Animals). Les candidats vaccins de nouvelle génération en développement (RVFV-4s, DDVax, ChAdOx1-RVF, MP12) repose sur un vecteur et sont destinés à un usage à la fois humain et vétérinaire. Parmi eux, le RVFV-4s, un virus divisé en quatre segments, et le DDVax, un virus avec deux délétions génétiques, sont conçus pour être hautement sécurisés. Incapables de se propager, ils réduisent les risques liés à la vaccination tout en permettant un suivi sérologique précis.
Les résultats, prometteurs, indiquent que ces vaccins pourraient offrir une protection efficace chez l’humain et réduire les risques de transmission, tout en facilitant la gestion des épidémies, ce qui est cruciale pour améliorer la prévention de cette maladie zoonotique dans les régions à risque.13
L’ANRS MIE a ouvert une cellule de crise de niveau 1 le 11 décembre 2025 en réponse à une épidémie au Sénégal et en Mauritanie, suspendue depuis.
Une veille scientifique régulière a été diffusée aux membres du réseau de l’agence et une réunion de recherche s’est tenue le 7 novembre 2025, réunissant des experts du Sénégal et de Mauritanie. Cette rencontre avait pour priorités de dresser l’état des lieux épidémiologique dans les deux pays, d’identifier les principaux obstacles à la riposte, de définir des axes de recherche prioritaires et de favoriser la mise en place de collaborations. Les échanges ont permis de dégager plusieurs axes de recherche :
- La santé animale et la vaccination et le besoin de développer des vaccins plus sûrs et traçables (type DIVA), de comprendre la persistance du virus dans le cheptel et d’analyser les flux commerciaux d’animaux
- Les systèmes d’alerte précoce, fondés sur des modèles climatiques et des données satellitaires, permettent d’anticiper les conditions favorables à une flambée épidémique et de déclencher des mesures de prévention ciblées avant l’apparition des premiers cas
- Étude de modélisation des stratégies de vaccination du bétail et de la population
- Les sciences sociales, essentielles pour analyser les perceptions communautaires, la confiance envers les autorités sanitaires, les pratiques liées à la consommation de viande et de lait, et l’acceptabilité des mesures de prévention.
Le réseau CORC
À travers son implication dans le réseau CORC de l’OMS (coordination du CORC sur les filovirus), l’ANRS MIE est invitée à discuter des priorités de recherche sur la fièvre de la Vallée du Rift à l’échelle internationale.
Ces discussions permettent de se coordonner avec les autres acteurs de la recherche, de suivre les travaux déjà engagés, d’identifier les avancées en cours et de mettre en évidence les domaines où des efforts supplémentaires sont nécessaires, afin de développer des projets complémentaires et renforcer la cohérence de la réponse scientifique mondiale.
Le réseau Arbo-France
Arbo-France, placé sous l’égide de l’ANRS MIE, est un réseau français d’étude des arboviroses dont l’objectif est de faciliter la préparation et la réponse aux épidémies d’arbovirus humains et animaux en métropole et dans les territoires ultra-marins.
Références
- Quellec J, et al. Infection par le virus de la fièvre de la vallée du Rift : physiopathologie et pathogenèse. Virologie 2021 ; 25 (5) : 263-279
- Pepin M, et al. Rift Valley fever virus (Bunyaviridae: Phlebovirus): an update on pathogenesis, molecular epidemiology, vectors, diagnostics and prevention. Vet Res 2010;41(6):61.
- Sissoko D, et al. Rift Valley Fever, Mayotte, 2007-2008. Emerg Infect Dis 2009;15(4):568-70.
- Préfet de Mayotte : Fièvre de la Vallée du Rift à Mayotte : point de situation au 2 août 2019. https://www.mayotte.gouv.fr/Actualites/Communiques-de-presse/Fievre-de-la-Vallee-du-Rift-a-Mayotte-point-de-situation-au-2-aout-2019#:~:text=Depuis%20le%20d%C3%A9but%20de%20la,foyers%20animaux%20ont%20%C3%A9t%C3%A9%20d%C3%A9clar%C3%A9s (consulté le 02/02/2026)
- Fauquet CM. Taxonomy, Classification and Nomenclature of Viruses. Encyclopedia of Virology 2008:9-23
- Lapa D, et al. Rift Valley Fever virus: An overview of the current status of diagnostics.
Biomedicines 2024;12(3):540 - OMS : Fièvre de la vallée du Rift. https://www.who.int/fr/news-room/fact-sheets/detail/rift-valley-fever (consulté le 02/02/2026)
- Annywaine Z, et al. Clinical manifestations of Rift Valley fever in humans: Systematic review and meta-analysis. PLoS Negl Trop Dis 2022;16(3):e0010233
- Lang Y, et al. Identification and evaluation of antivirals for Rift Valley fever virus. Vet Microbiol 2019;230:110‑116
- Scharton D, et al. Favipiravir (T-705) protects against peracute Rift Valley fever virus infection and reduces delayed-onset neurologic disease observed with ribavirin treatment. Antiviral Res 2014;104: 84-92
- Connors KA, et al. Potent neutralizing human monoclonal antibodies protect from Rift Valley fever encephalitis. JCI Insight 2024;9(18):e180151
- Pittman PR, et al. Immunogenicity of an inactivated Rift Valley fever vaccine in humans: a 12-year experience. Vaccine 1999;18(1-2):181-189
- Alkan C, et al. Advancements in Rift Valley fever vaccines: a historical overview and prospects for next generation candidates.
NPJ Vaccines 2023;8(1):171
