Oropouche
La maladie à virus Oropouche est une arbovirose circulant activement dans plusieurs régions d’Amérique centrale, d’Amérique du Sud et des Caraïbes.
Dernière mise à jour le 05 mai 2025
L’essentiel
- La maladie Oropouche est une arbovirose circulant activement dans plusieurs régions d’Amérique centrale, d’Amérique du Sud et des Caraïbes.
- À partir de 2023, le virus Oropouche a été à l’origine de grandes épidémies dans les régions endémiques, mais aussi dans des régions non affectées jusque-là.
Origine du virus Oropouche
Historique : retour sur l’épidémie de Oropouche
Le virus Oropouche (OROV) a été détecté pour la première fois en 1955 à Trinité-et-Tobago dans les Caraïbes, près de la rivière Oropouche.1 Depuis, il a sévi principalement en Amérique du Sud et Amérique Latine (Brésil, Panama, Pérou, Argentine, Bolivie, Colombie, Équateur et Guyane française).2-5
À partir de 2023, le virus a été à l’origine de grandes épidémies dans des régions historiquement endémiques, mais aussi dans des régions indemnes jusqu’alors.6 L’épidémie qui a débuté en juin 2024 à Cuba, bien qu’elle n’ait pas entraîné de cas sévères, a marqué une expansion géographique inédite du virus. Elle a touché les États-Unis et l’Europe (Allemagne, Italie, Espagne, Pays-Bas, France) en août 2024.7
La transmission directe, horizontale du virus n’avait jamais été documentée jusqu’à présent. Par ailleurs, au 30 juillet 2024, cinq cas de transmission verticale (c’est-à-dire de la mère à l’enfant pendant la grossesse) possible ont été identifiés au Brésil, ayant entraîné quatre cas de mortinatalité.6 Le risque potentiel pendant la grossesse et les effets de l’infection sur le fœtus sont en cours d’étude.8
Le virus Oropouche
La maladie Oropouche est une arbovirose causée par le virus OROV, un virus à ARN simple brin appartenant au genre Orthobunyavirus de la famille des Peribunyaviridae.
États des connaissances actuelles
Transmission
La transmission aux humains se fait principalement par la piqûre de petits moucherons du genre Culicoides paraensis vivant dans les zones forestières et humides. Ce sont les femelles qui piquent, ayant besoin de sang pour la maturation de leurs œufs fécondés. Après infection, la période d’incubation varie de 3 à 10 jours.
Symptômes
Les symptômes sont souvent non spécifiques et peuvent être facilement confondus avec ceux d’autres arboviroses telles que la Dengue, le Chikungunya ou le Zika. Les patients peuvent présenter une fièvre, des maux de tête, des nausées, des douleurs articulaires et musculaires, des conjonctivites et des douleurs abdominales.
Cependant, environ 80 % des personnes infectées restent asymptomatiques. La phase de convalescence est généralement d’une semaine, mais dans certains cas, elle peut se prolonger sur plusieurs semaines. Dans environ 4 % des cas symptomatiques, des formes sévères et neuro-invasives peuvent survenir, incluant des méningites et des encéphalites.
Diagnostic
Le diagnostic repose sur plusieurs méthodes. La détection du virus par RT-PCR est possible entre J1 et J7 après l’apparition des symptômes. Des tests sérologiques comme l’ELISA permettent également de détecter les anticorps IgM et IgG, produits à partir de J1 jusqu’à 2 semaines après l’apparition de la maladie.
Les échantillons biologiques utilisés pour ces analyses comprennent le sérum, la salive et l’urine. Chez les patients présentant des signes de maladies neuro-invasives, l’analyse du liquide céphalo-rachidien peut également être effectuée.
Traitement et prévention
À ce jour, le traitement est essentiellement symptomatique et consiste en une réhydratation et en l’administration d’analgésiques et d’antipyrétiques. Comme pour la Dengue, l’aspirine et les autres anti-inflammatoires non-stéroïdiens sont déconseillés, afin de minimiser les risques d’hémorragie.
Plusieurs candidats antiviraux ont été testés, cependant aucun n’a montré d’efficacité contre le virus. La ribavirine, qui a ainsi testée in vitro et in vivo, n’a pas démontré d’activité antivirale contre l’OROV, bien qu’elle ait été efficace contre d’autres Orthobunyavirus.
En ce qui concerne la prévention, il n’existe aucun vaccin contre Oropouche.
Les pistes de recherche sur la maladie Oropouche
Transmission
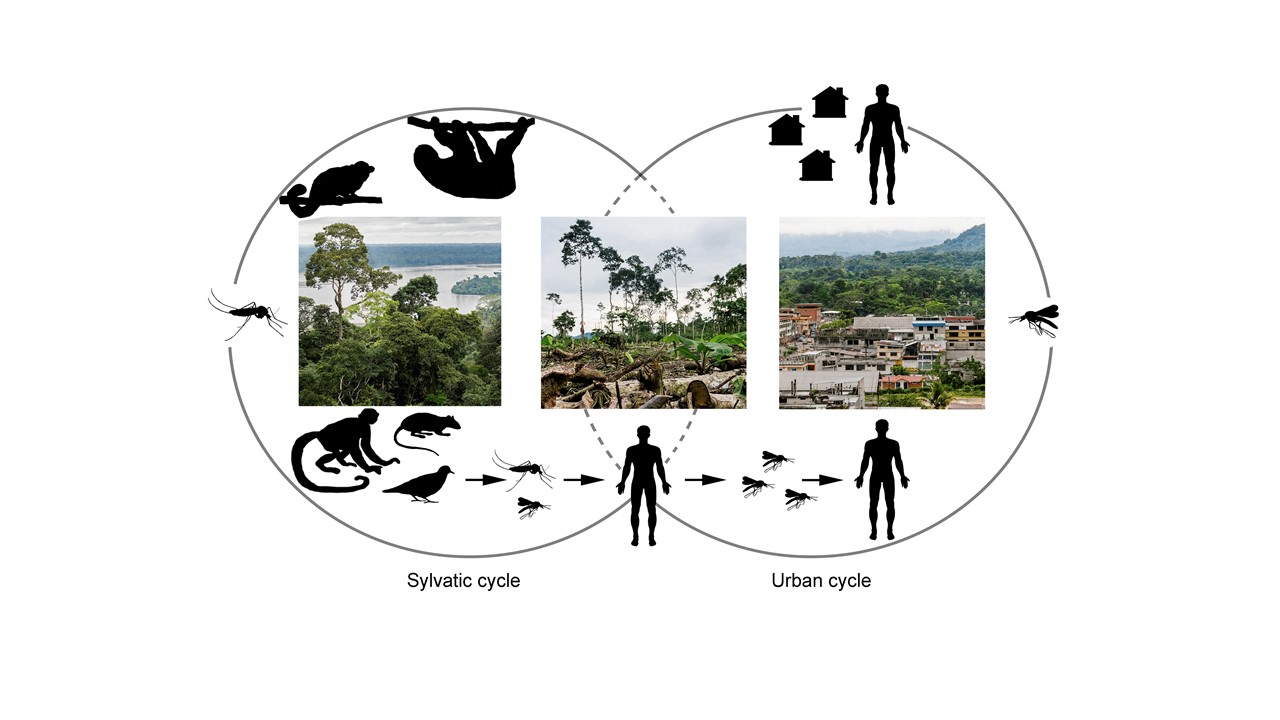
Les cycles de vie du virus Oropouche, sylvatique et urbain, restent mal connus.
Les paresseux, les primates non-humains et les oiseaux sauvages sont suspectés de jouer un rôle dans le maintien d’OROV. Néanmoins, leur rôle précis n’est pas connu. Il est également indispensable d’investiguer d’autres hôtes naturels, accidentels et amplificateurs potentiels encore méconnus, y compris parmi les animaux domestiques.
Parallèlement aux hôtes potentiels, le spectre des vecteurs d’OROV doit être approfondi. Si l’espèce Culicoides parensis continue d’être étudiée majoritairement, les autres espèces que l’on rencontre dans les lieux habités, telles que les moustiques Culex quinquefasciatus, Aedes serratus et Coquillettidia venezuelensis, devraient l’être davantage.
Il en ressort que des études sur la compétence vectorielle, de séroprévalence chez l’homme, et le renforcement de la surveillance entomologique dans les régions infectées permettraient de mieux caractériser la circulation réelle d’OROV.
La surveillance pourrait bénéficier des recherches sur la présence d’arbovirus dans les eaux usées pour identifier le niveau de circulation dans les populations humaines et anticiper les épidémies d’OROV et des autres arbovirus.9
Comme évoqué précédemment, les voies de transmission d’OROV sont également mal comprises : comme avec le virus Zika, la transmission verticale de la mère au fœtus semble possible.8
Pathogenèse
Les connaissances sur la pathogenèse d’OROV et les facteurs de risque associés à des formes sévères sont également limitées. Bien que la majorité des infections soient asymptomatiques, certaines populations comme les personnes âgées, les femmes enceintes, les populations immunodéprimées ou avec des comorbidités semblent plus vulnérables. En outre, les infections congénitales par OROV et son association possible avec des anomalies néonatales, telle que la microcéphalie sont encore peu documentées malgré des cas récemment observés.8
Les signes cliniques méritent donc d’être étudiés, de même que les séquelles à long terme chez les individus infectés par OROV, ainsi que la corrélation entre une virémie prolongée ou une charge virale élevée et la sévérité de l’infection.10
Diagnostic
Actuellement, Oropouche est une maladie largement sous-diagnostiquée, car les symptômes cliniques se confondent avec ceux des autres arboviroses comme la Dengue, le Chikungunya et le Zika, et nécessite une confirmation en laboratoire, retardant ainsi le diagnostic. Il serait important de développer des tests de diagnostic rapides pour OROV, ce qui permettrait une identification précoce du virus.
La détermination de l’échantillon le plus pertinent pour un diagnostic demeure. Des études approfondies sur la charge virale dans divers fluides corporels (salive, sang, urine) et leurs limites associées à leur analyse sont donc indispensables.
Le diagnostic d’une infection d’OROV par des échographies néonatales a commencé à être testé avec l’Institut Pasteur. En 2024, la Pan American Health Organization (PAHO ; Organisation panaméricaine de la santé) a publié des recommandations sur la détection en laboratoire et la surveillance des cas pour le virus Oropouche.11
Traitements et vaccins contre la maladie Oropouche
À ce jour, aucun traitement antiviral spécifique n’est disponible, et très peu d’essais cliniques ont été menés chez l’humain. Le favipiravir n’a pas encore été testé pour OROV, mais il montre une efficacité prometteuse sur plusieurs virus de la même famille des Peribunyaviridae.12
Le développement d’un vaccin efficace est aussi une priorité, mais les études sont encore très peu nombreuses. Un certain nombre d’épitopes des cellules T et B ont été identifiés à partir de la polyprotéine OROV pour des candidats vaccins.13 Par ailleurs, un candidat vaccin a été construit à partir du virus de la stomatite vésiculaire (VSV) exprimant les glycoprotéines de l’OROV. Il a été évalué et a montré un effet protecteur in vivo, avec une réduction de la charge virale après une exposition au virus.14
Une autre piste de recherche concerne l’immunité croisée avec des vaccins existants contre d’autres virus.
Lutte vectorielle
Il n’existe à ce jour pas de mesures efficaces, économiquement et écologiquement réalisables de contrôle des vecteurs, notamment pour le vecteur principal, Culicoides paranesis. Les insecticides chimiques comme la deltaméthrine et le N, N-Diethyl-meta-toluamide (DEET) ont démontré des effets insecticides satisfaisants contre les espèces de Culicoides.
Cependant les conséquences écologiques sont préoccupantes et l’éradication complète et permanente de ces vecteurs est impossible compte tenu de leur abondance. Divers composés naturels ont été proposés comme répulsifs. La technique de l’insecte incompatible et la technique de l’insecte stérile sont d’autres techniques de lutte vectorielle prometteuses contre Aedes spp, et peut-être aussi contre les Culicoides.15
Enfin, des travaux de recherche comportementale et sociologique doivent aussi être mis en place pour guider la lutte vectorielle et les interventions pour réduire le risque global.
Les actions de recherche de l’ANRS Maladies infectieuses émergentes sur la maladie Oropouche
La menace posée par le virus Oropouche ne doit pas être sous-estimée. Les lacunes dans la compréhension de son épidémiologie, de son écologie, de sa pathogénie et du risque de réassortiment avec d’autres Orthobunyavirus sont importantes.
Ainsi, combler cette méconnaissance semble essentiel, de même que le développement de contre-mesures efficaces pour améliorer les évaluations de risque et élaborer des stratégies de santé publique efficaces face à cette maladie négligée.
Une veille scientifique sur la maladie Oropouche
L’ANRS MIE a ouvert une cellule de crise de niveau 1 sur l’épidémie d’Oropouche en octobre 2024. Une veille scientifique y est disponible, mise à jour de manière régulière.
Des projets de recherche financés sur Oropouche
L’ANRS MIE a historiquement financé la cohorte VIROPREG, une cohorte sur la transmission mère-enfant du VIH. Le champ de cette cohorte prospective nationale a été étendu aux maladies infectieuses émergentes. VIROPREG prévoit d’étudier les issues néonatales défavorables et les effets de l’infection d’OROV chez les femmes enceintes, les fœtus et les nouveau-nés en France (y compris les territoires ultramarins).
L’animation scientifique sur Oropouche
En septembre 2024, l’ANRS MIE, en partenariat avec le réseau Arbo-France a organisé une concertation d’experts sur la maladie à virus Oropouche. Cette rencontre a permis de faire le point sur :
- La circulation du virus dans la région des Amériques,
- Le risque d’introduction dans les territoires ultramarins français,
- Le vecteur Culicoides,
- Les questions de recherche prioritaires.
Financement de la recherche sur Oropouche
La mission première de l’ANRS MIE est de faire avancer la recherche concernant les maladies infectieuses émergentes, telles que la maladie Oropouche. À cette fin, nous avons lancé divers projets de financement.
Découvrez tous nos appels à projets en cours ici.
Références
- Anderson Cr, et al. Oropouche virus: a new human disease agent from Trinidad, West Indies. Am J Trop Med Hyg 1961;10:574-8
- Sah R, et al. Oropouche fever outbreak in Brazil: an emerging concern in Latin America. Lancet Microbe 2024 Jul 3:S2666-5247(24)00136-8
- Gaillet M, et al. Outbreak of Oropouche Virus in French Guiana. Emerg Infect Dis 2021;27(10):2711-2714
- Gómez-Camargo DE, et al. Evidence of Oropouche Orthobunyavirus Infection, Colombia, 2017. Emerg Infect Dis 2021;27(6):1756-1758
- Gutierrez B, et al. Evolutionary Dynamics of Oropouche Virus in South America. J Virol 2020;94(5):e01127-19
- PAHO publishes update on Oropouche fever in the Americas, 2024 Jul. https://www.paho.org/en/news/10-9-2024-paho-publishes-update-oropouche-fever-americas (consulté le 03/10/2024)
- Morrison A, et al. Oropouche Virus Disease Among U.S. Travelers – United States, 2024. MMWR Morb Mortal Wkly Rep 2024;73(35):769-773
- Martins-Filho PR, et al. Oropouche fever: reports of vertical transmission and deaths in Brazil. Lancet Infect Dis 2024:S1473-3099(24)00557-7
- Lee WL, et al. Monitoring human arboviral diseases through wastewater surveillance: Challenges, progress and future opportunities. Water Res 2022;223:118904
- Wesselmann KM, et al. Emergence of Oropouche fever in Latin America: a narrative review. Lancet Infect Dis 2024;24(7):e439-e452
- Recommendations for the Detection and Surveillance of Oropouche in possible cases of vertical infection, congenital malformation, or fetal death, 2024 Jul. https://www.paho.org/en/documents/recommendations-detection-and-surveillance-oropouche-possible-cases-vertical-infection (consulté le 03/10/2024)
- Furuta Y, et al. Favipiravir (T-705), a broad spectrum inhibitor of viral RNA polymerase. Proc Jpn Acad Ser B Phys Biol. Sci. 2017;93 :449-463
- Adhikari UK, et al. Immunoinformatics Approach for Epitope-Based Peptide Vaccine Design and Active Site Prediction against Polyprotein of Emerging Oropouche Virus. J Immunol Res 2018;2018:6718083
- Stubbs SH, et al. Vesicular Stomatitis Virus Chimeras Expressing the Oropouche Virus Glycoproteins Elicit Protective Immune Responses in Mice. mBio 2021;12(4):e0046321
- Bansal S, et al. Effectiveness of Wolbachia-mediated sterility coupled with sterile insect technique to suppress adult Aedes aegypti populations in Singapore: a synthetic control study. Lancet Planet Health 2024;8(9):e617-e628
