Découverte d’un mécanisme de détournement du pore nucléaire par le virus de l’hépatite C pour favoriser l’assemblage de nouveaux virus
Comment le virus de l’hépatite C détourne-t-il la machinerie cellulaire pour produire des copies du virus et, in fine, se propager ? Un nouveau mécanisme a été mis en évidence par des chercheuses et chercheurs de l’équipe "Virus enveloppés, vecteurs et immunothérapie" du Centre international de recherche en infectiologie (CNRS/Inserm/ENS de Lyon/Université Claude-Bernard Lyon 1). Ces travaux ont été soutenus par l’ANRS | Maladies infectieuses émergentes.
Publié le 08 avril 2022
S’il existe aujourd’hui des traitements très efficaces pour guérir l’hépatite C, cette maladie demeure un véritable problème de santé publique, avec plus de 70 millions de personnes touchées dans le monde. Une meilleure connaissance des mécanismes d’action de ce virus est encore essentielle, motivant les équipes de recherche fondamentale, translationnelle et clinique à poursuivre leurs travaux.
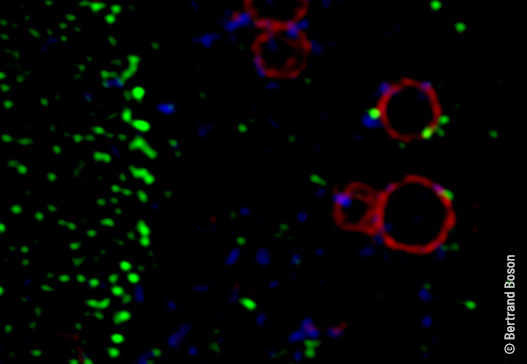
De nombreux virus, dont celui responsable de l’hépatite C (VHC), détournent le pore nucléaire de la cellule – l’énorme complexe protéique qui, en traversant l’enveloppe du noyau cellulaire, régule l’échange de protéines et d’ARN entre le noyau et le cytoplasme. Pour utiliser à leur avantage les fonctions du pore nucléaire, ces virus ciblent ses composants afin, par exemple, de bloquer la réponse immunitaire innée de l’hôte ou de réduire la traduction cellulaire au profit de la traduction virale. De récents travaux portant sur le virus de l’hépatite C ont identifié un nouveau mécanisme de détournement du pore nucléaire et de ses composantes cytoplasmiques, les Annulate lamellae (1), dont la fonction reste à ce jour énigmatique.
En combinant des approches d’imagerie confocale et de biochimie, les auteurs de cette étude ont montré que la protéine de la capside du VHC (la protéine core) relocalise la nucléoporine Nup98, une molécule majeure du pore nucléaire, à partir des structures Annulate Lamellae cytosoliques vers les sites de traduction et de réplication virale. Cette redistribution dans le cytoplasme est faite au profit de l’assemblage viral : Nup98 peut alors interagir avec le génome viral et le maintenir à proximité des sites d’assemblage du VHC, favorisant son encapsidation et, ainsi, la fabrication de nouveaux virus.
C’est la première étude élucidant le rôle précis de Nup98 dans l’assemblage du VHC et un nouveau mécanisme mettant en évidence la façon dont le VHC détourne certains composants cellulaires pour son propre bénéfice.
1. Les Annulate lamellae sont des organelles cytoplasmiques contenant des feuillets empilées de membranes entourées de complexes de pores morphologiquement similaires aux complexes de pores de l’enveloppe nucléaire.

En savoir plus
Nup98 Is Subverted from Annulate Lamellae by Hepatitis C Virus Core Protein to Foster Viral Assembly
Boson B (1), Mialon C (1), Schichl K (1), Denolly S (1), Cosset FL (1).
mBio.
1. Centre international de recherche en infectiologie (CIRI), CNRS/Inserm/ENS de Lyon/Université Claude-Bernard Lyon 1
